
En la crisis sanitaria que actualmente vive el mundo entero por la pandemia del coronavirus, muchas personas están a la espera de la ansiada vacuna o de un fármaco que controle las consecuencias de contraer el virus que ya se ha llevado la vida de tantos.
El uso de medicamentos está directamente relacionado con el aumento de la esperanza de vida: el 74% de este aumento en los países desarrollados se debe directamente a los nuevos medicamentos. Sin embargo, la investigación de un fármaco y su llegada un día al paciente es un proceso largo, complejo y costoso.
Es largo, porque se precisan entre 10 y 13 años para su desarrollo:
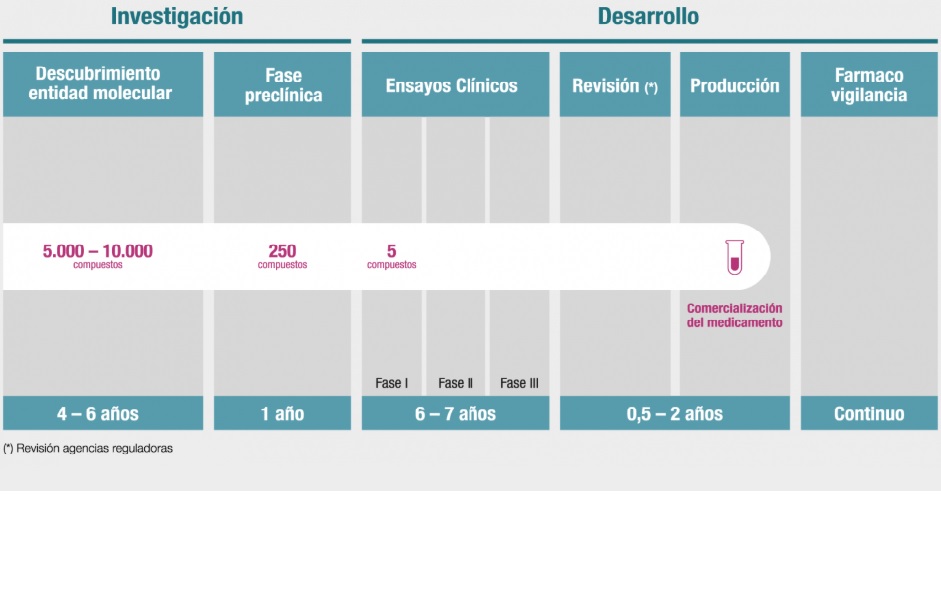
El descubrimiento de un nuevo fármaco comienza en el laboratorio, cuyos investigadores, previamente formados para tener un conocimiento profundo de una enfermedad, identificarán una diana específica (como puede ser el origen de una patología) y ésta será el objetivo al que se dirigirá la nueva molécula o fármaco que posteriormente se desarrollará.
Aquí pueden surgir los primeros obstáculos para el descubrimiento de un nuevo medicamento, porque a veces el dardo (la molécula) o la diana no son los adecuados o el compuesto seleccionado finalmente no puede convertirse en un fármaco.
Fases
El siguiente paso que, como el anterior, forma parte del proceso de la investigación, es la fase preclínica, que implica el ensayo del compuesto en organismos vivos y estudios sobre farmacología y toxicología, entre otros. Las compañías farmacéuticas necesitan entre 5 y 7 años para completar estas dos primeras etapas.
Una vez superados estos pasos previos comienza lo que se conoce como fase clínica y es cuando da comienzo el ensayo en el que, por primera vez, participarán personas –normalmente es el médico el que invita a un paciente a participar en el estudio–. Los ensayos clínicos son, en términos generales, estudios de investigación con voluntarios sanos o pacientes que prueban la seguridad y eficacia de un nuevo medicamento.
Son una pieza crítica en la innovación terapéutica y representan una oportunidad única para los pacientes (puesto que pueden tener acceso a un tratamiento en investigación que puede ser la última oportunidad para muchos), para los profesionales sanitarios (que participan de la investigación más puntera) y para la calidad de la prestación sanitaria y del Sistema Nacional de Salud (puesto que todo ese conocimiento investigador se puede aplicar a la labor asistencial).
Esta fase final de la carrera de fondo que supone la I+D de fármacos consta de cuatro etapas:
- Fase I: sirve para probar la seguridad del medicamento en un pequeño grupo
de voluntarios, tanto sanos como pacientes - Fase II: evalúa la eficacia del compuesto contra una enfermedad concreta
- Fase III: emplea a un número mayor de sujetos para confirmar los resultados
de las dos primeras fases - Fase IV: analiza el comportamiento del nuevo medicamento ya en el mercado
El procedimiento administrativo para la aprobación de una nueva terapia también debe tenerse en cuenta al medir el tiempo que tarda un medicamento en estar disponible para los pacientes. De media, a los cinco años que puede durar la fase clínica habría que sumarle entre 12 y 18 meses para que las autoridades regulatorias aprueben su puesta en el mercado.
España, líder internacional en ensayos clínicos
España es uno de los países representativos en la realización de ensayos clínicos. El hecho de haber sido el primer Estado miembro en tener una regulación (en vigor desde 2016) adaptada a las nuevas directrices europeas ha contribuido a lograrlo. Para muchas compañías nuestro país es una de las primeras opciones para realizar este tipo de estudios, sólo por detrás de potencias como Estados Unidos.
La preparación de los profesionales sanitarios, la reputación de los centros hospitalarios y la implicación de las asociaciones de pacientes son, junto con el apoyo de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), otras de las palancas que han posicionado bien a España.
Es importante que entre pacientes, familiares, cuidadores e incluso profesionales sanitarios se conozca mejor el valor que tiene la investigación biomédica, en general, y la investigación y desarrollo de nuevos medicamentos, en particular. Por este motivo, Farmaindustria lleva años comprometida con trasladar esta información y conocimiento a la sociedad en su conjunto, porque en la actualidad resulta especialmente relevante y necesaria.
El proyecto "Acercando la ciencia a las escuelas", realizado en colaboración con hospitales y centros de investigación españoles y en el que estudiantes de bachillerato conocen en qué consiste el proceso de investigación de un medicamento, es un ejemplo de este compromiso.
Asimismo, la Academia Europea de Pacientes (Eupati) se ha implicado también de manera importante en la divulgación de la importancia de participar en los ensayos clínicos de nuevos medicamentos y en la formación de los propios pacientes para potenciar su participación, por lo que se ha convertido en una fuente de referencia para muchos colectivos de pacientes.
